C’est un concept biologique totalement nouveau qui trouve sa place chez les chercheurs en cytologie. Un phénomène physico-chimique simplissime qui résout bien des énigmes du Vivant : certaines protéines, par milliers, peuvent se condenser ou se délayer dans une microzone, activant ainsi des processus cellulaires.
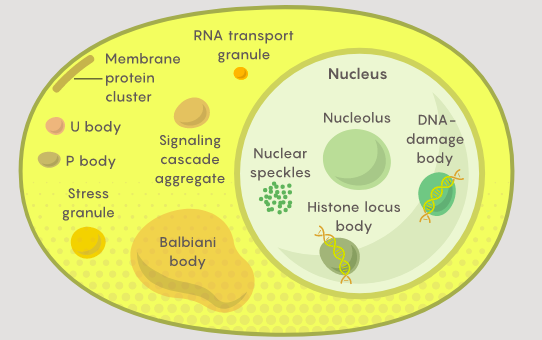
D’une manière ou d’une autre, dans le cytoplasme surchargé, les enzymes doivent trouver leurs substrats et les molécules de signalisation doivent trouver leurs récepteurs, afin que la cellule puisse effectuer le travail de croissance, de division et de survie.
Si les cellules ballottaient des sacs de cytoplasme uniformément mélangé, ce serait difficile à réaliser. Mais ils ne le sont pas. Les organites membranaires aident à organiser une partie du contenu, compartimentant utilement des ensembles de matériaux et fournissant des surfaces qui permettent des processus importants, tels que la production d’ATP, le carburant biochimique des cellules.
Mais, comme les scientifiques commencent à peine à l’apprécier, ils ne sont qu’une source d’ordre.
De nombreux processus vitaux dans les cellules sont régulés par des nuages de protéines et d’autres molécules qui fusionnent en condensats selon un besoin, puis se dispersent.
Ces expériences récentes révèlent que certaines protéines se rassemblent spontanément en assemblages transitoires appelés condensats, en réponse à des forces moléculaires qui équilibrent précisément les transitions entre la formation et la dissolution de gouttelettes à l’intérieur de la cellule.
Les condensats, parfois appelés organites sans membrane, peuvent séquestrer des protéines spécifiques du reste du cytoplasme, empêchant les réactions biochimiques indésirables et augmentant considérablement l’efficacité des protéines utiles. Ces découvertes modifient notre compréhension fondamentale du fonctionnement des cellules.
Par exemple, les condensats peuvent expliquer la vitesse de nombreux processus cellulaires. Cela ressemble à un flash mob. Vous allumez la radio, et tout le monde se réunit, puis vous l’éteignez et tout le monde disparaît.
Le mécanisme est «extrêmement régulable, on peut former ces condensats et les dissoudre assez facilement en changeant simplement les concentrations de molécules» ou en modifiant chimiquement les protéines. Cette précision fournit un levier pour contrôler une foule d’autres phénomènes, y compris l’expression génique.
Il y a désormais un véritable flot de recherches sur les condensats biomoléculaires, ces compartiments cellulaires liquides aux propriétés à la fois élastiques et visqueuses.
Maintenant, les biologistes cellulaires semblent trouver des condensats partout où ils regardent: dans la régulation de l’expression des gènes, la formation de fuseaux mitotiques, l’assemblage des ribosomes et bien d’autres processus cellulaires dans le noyau et le cytoplasme. Ces condensats ne sont pas seulement nouveaux mais suscitent la réflexion: l’idée que leurs fonctions émergent des comportements collectifs des molécules est devenue le concept central de la biologie des condensats, et elle contraste fortement avec l’image classique des paires d’agents biochimiques et de leurs cibles s’emboîtant comme des serrures et des clés. Les chercheurs cherchent encore à sonder la fonctionnalité de ces propriétés émergentes; cela nécessitera le développement de nouvelles techniques pour mesurer et manipuler la viscosité et d’autres propriétés de minuscules gouttelettes dans une cellule.
Comment se forment les condensats
Lorsque les biologistes ont tenté d’expliquer ce qui était à l’origine du phénomène de séparation de phase derrière la condensation dans les cellules vivantes, la structure des protéines elles-mêmes offrait un point de départ naturel. Les protéines bien repliées contiennent généralement un mélange d’acides aminés hydrophiles et hydrophobes. Les acides aminés hydrophobes ont tendance à s’enfouir à l’intérieur des plis protéiques, loin des molécules d’eau, tandis que les acides aminés hydrophiles sont attirés vers la surface. Ces acides aminés hydrophobes et hydrophiles déterminent comment la protéine se replie et conserve sa forme.
Mais certaines chaînes protéiques ont relativement peu d’acides aminés hydrophobes, elles n’ont donc aucune raison de se replier. Au lieu de cela, ces protéines intrinsèquement désordonnées (IDP) fluctuent en forme et s’engagent dans de nombreuses interactions multivalentes faibles. Les interactions IDP ont été considérées pendant des années comme la meilleure explication du comportement des gouttelettes fluides.
L’oligomérisation (et non pas polymérisation, qui elle est quasi définitive), se produit lorsque les protéines se lient les unes aux autres et forment des complexes plus grands avec des unités répétitives, appelées oligomères. Au fur et à mesure que la concentration de protéines augmente, la séparation de phases et la formation d’oligomères augmentent également. Lors d’une conférence à la réunion de l’American Society for Cell Biology en décembre, Brangwynne a montré qu’à mesure que la concentration d’oligomères augmente, la force de leurs interactions surmonte finalement la barrière de nucléation, l’énergie nécessaire pour créer une surface séparant le condensat du reste du cytoplasme. À ce stade, les protéines se rapprochent pour former un condensat.
Condensats et expression génique
Les condensats semblent être impliqués dans de nombreux aspects de la biologie cellulaire, mais un domaine qui a reçu une attention particulière est l’expression des gènes et la production de protéines.
Les ribosomes sont des usines de fabrication de protéines cellulaires, et leur nombre dans une cellule limite souvent son taux de croissance. Les travaux de Brangwynne et d’autres suggèrent que les cellules à croissance rapide pourraient obtenir de l’aide du plus gros condensat du noyau: le nucléole. Le nucléole facilite la transcription rapide des ARN ribosomiques en rassemblant tous les mécanismes de transcription nécessaires, y compris l’enzyme spécifique (ARN polymérase I) qui les fabrique.
L’été dernier, Weber a publié une étude montrant que dans les cellules de bactéries E. coli à croissance lente, l’enzyme ARN polymérase est uniformément distribuée, mais dans les cellules à croissance rapide, elle se regroupe en condensats. Les cellules à croissance rapide peuvent avoir besoin de concentrer la polymérase autour des gènes ribosomaux pour synthétiser efficacement l’ARN ribosomal.

Bien que Weber et Brangwynne aient montré que la transcription active se produit dans un gros condensat, le nucléole, d’autres condensats dans le noyau font le contraire. De grandes parties de l’ADN dans le noyau sont classées comme hétérochromatine car elles sont plus compactes et ne sont généralement pas exprimées sous forme de protéines. En 2017, Karpen, Amy Strom ont montré qu’une certaine protéine subira une séparation de phase et formera des gouttelettes sur l’hétérochromatine dans des embryons de drosophile. Ces gouttelettes peuvent fusionner les unes avec les autres, fournissant éventuellement un mécanisme de compactage de l’hétérochromatine à l’intérieur du noyau.
Les résultats suggèrent également une explication possible passionnante d’un mystère de longue date. Il y a des années, les généticiens ont découvert que s’ils prenaient un gène activement exprimé et le plaçaient juste à côté de l’hétérochromatine, le gène serait réduit au silence, comme si l’état d’hétérochromatine se propageait. «Ce phénomène de propagation est apparu très tôt, et personne ne l’a vraiment compris», a déclaré Karpen.
Plus tard, les chercheurs ont découvert des enzymes impliquées dans la régulation épigénétique appelées méthyltransférases, et ils ont émis l’hypothèse que les méthyltransférases passeraient simplement d’une histone à l’autre le long du brin d’ADN de l’hétérochromatine à l’euchromatine adjacente, une sorte de «mécanisme de traitement enzymatique», Karpen mentionné. C’est le modèle dominant pour expliquer le phénomène de propagation au cours des 20 dernières années.
Mais Karpen pense que les condensats qui se trouvent sur l’hétérochromatine, comme des billes humides sur une corde, pourraient être les produits d’un mécanisme différent qui explique la propagation de l’état d’hétérochromatine silencieuse. «Ce sont des façons fondamentalement différentes de penser au fonctionnement de la biologie», a-t-il déclaré. Il s’efforce maintenant de tester l’hypothèse.
La formation des filaments
Les condensats ont également aidé à résoudre un mystère cellulaire différent – pas à l’intérieur du noyau, mais le long de la membrane cellulaire. Lorsqu’un ligand se lie à une protéine réceptrice à la surface d’une cellule, il initie une cascade de changements moléculaires et de mouvements qui transmettent un signal à travers le cytoplasme. Mais pour que cela se produise, il faut d’abord que quelque chose rassemble tous les acteurs dispersés du mécanisme. Les chercheurs pensent maintenant que la séparation de phase pourrait être une astuce utilisée par les cellules pour regrouper les molécules de signalisation requises au niveau du récepteur membranaire.
La polymérisation de la tubuline est essentielle à la formation des fuseaux mitotiques qui aident les cellules à se diviser.
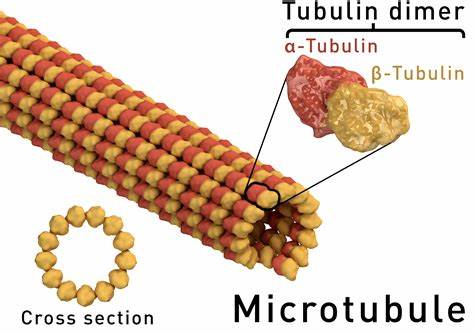
Dans une expérience in vitro, Hyman et son équipe ont créé des gouttelettes de la protéine tau se liant aux microtubules, puis ont ajouté de la tubuline, qui migre dans les condensats de tau. Lorsqu’ils ont ajouté des nucléotides aux condensats pour simuler la polymérisation, les monomères de tubuline se sont assemblés en de beaux microtubules. Hyman et ses collègues ont proposé que la séparation de phase pourrait être un moyen général pour les cellules d’initier la polymérisation des microtubules et la formation du fuseau mitotique.
La protéine tau est également connue pour former les agrégats de protéines qui sont les caractéristiques de la maladie d’Alzheimer. En fait, de nombreuses affections neurodégénératives, telles que la sclérose latérale amyotrophique (SLA) et la maladie de Parkinson, impliquent la formation défectueuse d’agrégats de protéines dans les cellules.
Peut-être que la question n’est pas de savoir pourquoi les agrégats se forment dans la maladie, mais pourquoi ils ne se forment pas dans des cellules saines. «L’une des choses que je demande souvent dans les réunions de groupe est la suivante: pourquoi la cellule ne ressemble pas à des œufs brouillés?» Hyman a déclaré dans son discours à la réunion de biologie cellulaire; la teneur en protéines du cytoplasme est «tellement concentrée qu’il devrait simplement s’échapper de la solution».
Un indice est venu lorsque des chercheurs du laboratoire de Hyman ont ajouté le carburant cellulaire ATP à des condensats de protéines de granules de stress purifiées et ont vu ces condensats disparaître.
Pour approfondir leurs recherches, les chercheurs ont mis des blancs d’œufs dans des tubes à essai, ont ajouté de l’ATP dans un tube et du sel dans l’autre, puis les ont chauffés. Alors que les blancs d’œufs dans le sel se sont agrégés, ceux contenant de l’ATP ne l’ont pas fait: L’ATP empêchait l’agrégation des protéines aux concentrations trouvées dans les cellules vivantes.
Mais comment? Cela resta un casse-tête jusqu’à ce que Hyman rencontre par hasard un chimiste lors de la présentation d’un séminaire à Bangalore. Le chimiste a noté que dans les procédés industriels, des additifs appelés hydrotropes sont utilisés pour augmenter la solubilité des molécules hydrophobes. De retour dans son laboratoire, Hyman et ses collègues ont découvert que l’ATP fonctionnait exceptionnellement bien comme hydrotrope.
Curieusement, l’ATP est un métabolite très abondant dans les cellules, avec une concentration typique de 3 à 5 millimolaires. La plupart des enzymes qui utilisent l’ATP fonctionnent efficacement avec des concentrations inférieures de trois ordres de grandeur. Pourquoi, alors, l’ATP est-il si concentré à l’intérieur des cellules, s’il n’est pas nécessaire pour déclencher des réactions métaboliques?
Une explication possible, suggère Hyman, est que l’ATP n’agit pas comme un hydrotrope en dessous de 3 à 5 millimolaires. «Une possibilité est qu’à l’origine de la vie, l’ATP ait évolué en tant qu’hydrotrope biologique pour maintenir les biomolécules solubles à haute concentration et a ensuite été coopté comme énergie», a-t-il déclaré.
Il est difficile de tester cette hypothèse de manière expérimentale, admet Hyman, car il est difficile de manipuler les propriétés hydrotropes de l’ATP sans affecter également sa fonction énergétique. Mais si l’idée est correcte, cela pourrait aider à expliquer pourquoi les agrégats de protéines se forment couramment dans les maladies associées au vieillissement, car la production d’ATP devient moins efficace avec l’âge.
Autres utilisations des gouttelettes
Prenez des ovocytes primordiaux, des cellules des ovaires qui peuvent rester dormantes pendant des décennies avant de devenir un œuf. Chacune de ces cellules a un corps Balbiani, un gros condensat de protéine amyloïde que l’on trouve dans les ovocytes d’organismes allant des araignées aux humains. On pense que le corps de Balbiani protège les mitochondries pendant la phase de dormance de l’ovocyte en regroupant la majorité des mitochondries avec de longues fibres de protéines amyloïdes. Lorsque l’ovocyte commence à mûrir en ovule, ces fibres amyloïdes se dissolvent et le corps Balbiani disparaît.
Les agrégats de protéines peuvent également résoudre des problèmes qui nécessitent des réponses physiologiques très rapides, comme l’arrêt des saignements après une blessure. Par exemple, Mucor circinelloides est une espèce fongique avec des réseaux interconnectés et pressurisés d’hyphes radiculaires à travers lesquels les nutriments circulent. Des chercheurs du laboratoire des sciences de la vie de Temasek, dirigé par le biologiste évolutif des cellules Greg Jedd, ont récemment découvert que lorsqu’ils blessaient la pointe d’un hyphe de Mucor, le protoplasme jaillissait au début mais formait presque instantanément un bouchon gélatineux qui arrêtait le saignement.
Jedd soupçonnait que cette réponse était médiée par un long polymère, probablement une protéine à structure répétitive. Les chercheurs ont identifié deux protéines candidates et ont découvert que, sans elles, les champignons blessés saignaient de manière catastrophique dans une flaque de protoplasme.
Jedd et ses collègues ont étudié la structure des deux protéines, qu’ils appelaient gelline A et gelline B. Les protéines avaient 10 domaines répétitifs, dont certains avaient des acides aminés hydrophobes qui pouvaient se lier aux membranes cellulaires. Les protéines se sont également déployées à des forces similaires à celles qu’elles subiraient lorsque le protoplasme jaillit sur le site d’une blessure. “Il y a cette accélération massive du flux, et nous pensions donc que c’est peut-être le déclencheur qui dit au gellin de changer d’état”, a déclaré Jedd. Le bouchon, déclenché par un signal physique qui fait passer la gelline de la phase liquide à la phase solide, est solidifié de manière irréversible.
Reconsidérer les anciennes explications
La séparation de phase s’est avérée être omniprésente et les chercheurs ont généré de nombreuses idées sur la façon dont ce phénomène pourrait être impliqué dans diverses fonctions cellulaires.
Les incertitudes ne découragent pas non plus Hyman. «Ce que la séparation de phase permet à tout le monde de faire, c’est de revenir en arrière et de regarder les anciens problèmes qui se sont arrêtés et de penser: Pouvons-nous maintenant y penser différemment?» il a dit. «Toute la biologie structurale qui a été réalisée vient d’être brillante – mais de nombreux problèmes sont restés lettre morte. Ils ne pouvaient pas vraiment expliquer les choses. Et c’est ce que la séparation de phase a permis, c’est que tout le monde repense à ces problèmes. “
