Pouvoir “cultiver” des tissus oculaires (cristallin, rétine, cornée) à partir de cellules souches du malade, c’est un but devenu raisonnable.
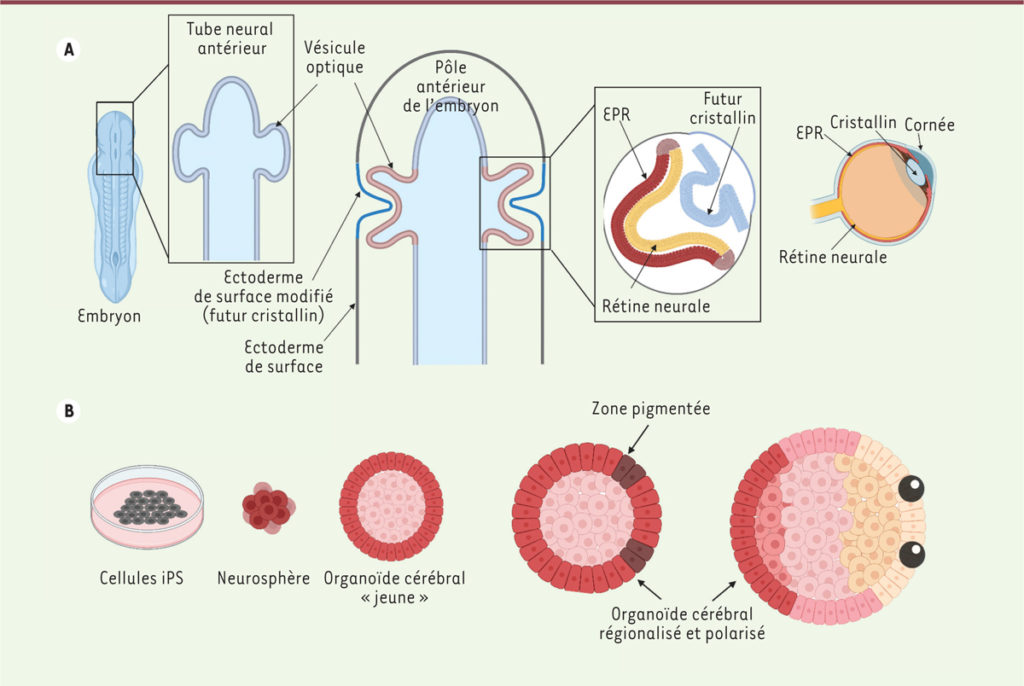
Nous avons ci-dessus le schéma de formation des organes de la vue chez l’embryon (ici un batracien) et en dessous, le développement en culture de cellules souches pour former un organoïde.
ligne A: Lors du développement embryonnaire, le tube neural antérieur (futur encéphale) présente une évagination à l’origine de deux vésicules optiques ; par interaction réciproque avec l’ectoderme de surface, les vésicules optiques vont s’invaginer pour former une structure à deux couches. L’une d’entre elles formera l’épithélium pigmentaire rétinien (EPR, en rouge), l’autre la rétine neurale (en jaune). Dans le même temps, l’épithélium de surface au contact de la vésicule optique formera le futur cristallin, puis, par la suite, la cornée.
Ligne B: De gauche à droite : les cellules souches iPS, mises en culture en suspension et dans un milieu favorable à la formation de structures neurales, vont former de petits agrégats appelés « neurosphères ». Cultivées en présence de Matrigel et d’acétate de rétinol, ces neurosphères se différencient en organoïdes cérébraux qui vont progressivement se polariser et présenter des territoires pigmentés, avec une identité oculaire. Généralement au nombre de deux et situées au même pôle de l’organoïde, ces régions évolueront vers des structures plus complexes, contenant des cellules de l’épithélium pigmentaire rétinien (EPR), des neurones rétiniens et des cellules caractéristiques des autres tissus oculaires, comme le cristallin et la cornée.
Les analyses de séquençage des ARN messagers à l’échelle d’une seule cellule ont permis de caractériser, à différents stades de développement, les différentes populations cellulaires qui composent ces organoïdes. Ces analyses ont confirmé l’existence dans la structure, de populations neuronales caractéristiques de différentes régions cérébrales (cerveau antérieur dorsal et cerveau antérieur ventral), du territoire oculaire et des vésicules optiques, dès le 30e jour de différenciation. Plus tardivement (après 60 jours de différenciation), le même type d’analyse du transcriptome révèle une maturation et une plus grande diversification cellulaire [9]. Des neurones excitateurs et inhibiteurs corticaux, des sous-types de neurones rétiniens, ainsi que des neurones de différentes régions spécifiques des voies visuelles, telles que le chiasma optique ou le corps genouillé latéral du thalamus ont ainsi été identifiés. De façon toute aussi surprenante que fascinante, l’analyse transcriptomique a également révélé la présence de signatures caractéristiques des épithéliums du cristallin et de la cornée, deux structures oculaires majeures jouant le rôle de lentille optique. Les immunomarquages ont confirmé la formation de ces structures oculaires au sein des organoïdes cérébraux, au-delà des seules structures rétiniennes [9].
Si la rétine a la même origine embryologique que le cerveau antérieur, la cornée et le cristallin dérivent de l’ectoderme de surface, ce qui suggère que le processus développemental des organoïdes cérébraux pourvus de structures oculaires intègre des étapes de développement complexes.
Des enregistrements électrophysiologiques réalisés sur ces organoïdes confirment l’existence de neurones suffisamment matures pour produire des signaux électriques [9]. Certains organoïdes pourvus de vésicules optiques présentent une sensibilité à la lumière, avec des délais de réponse autour de 500 ms, une valeur compatible avec un processus de photo-transduction. L’immaturité des photorécepteurs suggère que ces réponses pourraient être celles de CGR intrinsèquement photosensibles, dont l’existence est bien connue [10]. L’intensité lumineuse nécessaire, environ 1 000 fois plus élevée que pour une véritable rétine, pourrait s’expliquer par le niveau de maturité insuffisant et un niveau d’expression relativement faible des acteurs de la cascade de photo-transduction dans les organoïdes encore en développement.
Les organoïdes décrits dans cette étude ne semblent viables que pendant environ 60 jours, alors que les organoïdes rétiniens ou les organoïdes cérébraux peuvent être cultivés pendant plusieurs mois. Cette limite temporelle empêche le processus développemental de se poursuivre, ce qui exclut, à l’heure actuelle, l’étude de la maturation de ces structures et des circuits qui en découlent, comme ceux permettant aux photorécepteurs matures de communiquer avec les CGR puis avec l’ensemble du système visuel ; une analyse qui n’a encore jamais pu être faite. L’adaptation des conditions de culture permettant la poursuite du développement de ces structures œil-cerveau est un nouveau défi pour ce type d’organoïde révolutionnaire.
Gaël Orieux et Olivier Goureau dans Medecine/Science
Institut de la vision, Sorbonne Université, Inserm, CNRS, 17 rue Moreau, F-75012 Paris, France
