Ces microvésicules qu’on croyait dévolues à une simple épuration du contenu cellulaire, sont surtout un moyen permanent de recycler des éléments membranaires essentiels, et de communiquer très finement avec les autres cellules de l’environnement. Cette communication est désormais mieux comprise, et permet d’envisager des options thérapeutiques surprenantes. En particulier dans le cas des viroses et du cancer.
Une caractéristique de la vie, est de se développer à l’intérieur d’une membrane quasi-universelle pour tous les êtres, la membrane lipidique. A partir des premières « bulles de savon » qui ont isolé les ingrédients de la vie et permis son développement, les organismes ont développé tout un réseau membranaire, tant intérieur pour former des organites essentiels (réticulum, golgi, mitochondries, membrane nucléaire, vacuoles diverses…) et leurs communications réciproques, qu’extérieur (pseudopodes, exosomes), pour communiquer avec d’autres cellules.
Une autre grande caractéristique de la vie, est son incroyable sens de l’économie et du recyclage. Les clichés de microscopie électronique qui nous ont permis, dans les années 60, de découvrir toute cette complexité interne de la cellule, avaient le grave défaut de ne montrer qu’une image figée, avec de nombreux artefacts dus à la congélation ou à l’action de réactifs agressifs. Ils ne permettaient pas de comprendre que la cellule est en permanente restructuration, avec des échanges internes et externes qui mettent en jeu à chaque fois des structures membranaires.

Tout en bas, en périphérie du noyau cellulaire, se trouve le réticulum endoplasmique avec ses petits granules, les ribosomes. C’est là que s’élaborent l’ensemble des protéines caractéristiques de la cellule :
- les protéines de structure pour la cellule elle-même.
- les enzymes spécifiques de cette cellule.
- les productions spécifiques au type de cellule (une hormone, un enzyme, etc.).
Ces productions sont en permanence reconnues et accompagnées par des protéines membranaires (tout ce réticulum est un empilement de feuillets membranaires) qui ont un pôle interne adhérent à ces molécules produites, et un pôle externe, qui baigne dans le cytoplasme cellulaire dans lequel des petits moteurs moléculaires permettent de les mobiliser dans une direction judicieuse.
La direction principale, c’est le golgi, un autre empilement de feuillets membranaires, dans lequel tout un pool enzymatique permet le tri, puis la maturation des molécules « brutes » synthétisées dans le réticulum.
Comme dans toute fabrication, il y a des déchets : toutes les molécules inutiles sont rassemblées dans des vésicules en direction d’un « digesteur » permanent, le lysosome, qui va dissoudre ces déchets et les recycler dans la cellule, ou bien s’en débarrasser à l’extérieur via des vésicules.
Dans le règne végétal où les cellules sont coincées dans une cuirasse ligneuse, il n’y a pas de possibilité d’excrétion : les cellules accumulent alors de nombreuses substances sous la forme la moins dispendieuse en énergie et la plus concentrée possible, c’est pour cela que de nombreuses plantes ont accumulé des corps toxiques … qui sont devenus nos médicaments.
Dans la cellule animale, les protéines « utiles » sont transportées dans des petites vésicules vers la destination convenable dans la cellule, ou bien vers l’extérieur. Dans ce dernier cas, ces vésicules sont appelées exosomes.
Mais ce mouvement centrifuge n’est pas unique, sinon la cellule se viderait de sa substance et dépérirait bien vite : il existe un autre processus inverse, qui consiste à internaliser sous forme de petites vésicules (endosomes), à la fois des portions de membrane avec leurs récepteurs protéiques, et des substrats de l’extérieurs qui auront été captés par ces récepteurs. Ces endosomes vont avoir un cheminement original, et vont rejoindre elles aussi le golgi pour y déverser leurs prises intéressantes, le reste allant se faire digérer dans des lysosomes.
On note au passage que tout le matériel membranaire (phospholipides, cholestérol) est récupéré par le golgi pour renforcer les parois des « citernes golgiennes », ou bien récupéré par la membrane externe, avec ses récepteurs, là où « percent » les exosomes qui se vident vers l’extérieur.
On a donc un recyclage très efficace de tout ce qui constitue le système membranaire, pas un acide gras, pas un récepteur n’est perdu. Quand nous nous rasons, que nous coupons nos cheveux, que nous enlevons notre crasse avec du savon, c’est autant de perdu pour notre économie corporelle. La cellule, elle, récupère toute sa « périphérie » pour la recycler entièrement.
LA VOIE ENDOCYTAIRE
Nous venons de le voir, c’est le flux permanent d’absorbtion sous forme de vésicules, de « tout ce qui traîne » à la surface de la cellule.
Ces vésicules contiennent des récepteurs de surface, ainsi que les ligands qui y sont accrochés (virus, protéine de nutrition, hormone, messagers divers), plus quelques molécules du milieu extérieur qui se trouvaient là lors de l’invagination de la vésicule.
L’endosome entame alors un trajet au cours duquel des transformations internes permettront divers destinations à son contenu. On a à ce moment affaire à l’endosome précoce, ou EE : early endosome.
Très vite, la membrane de l’endosome absorbe des protons H+ qui vont réduire le pH du contenu. Cette acidification libère les ligands internés de leur récepteur : on a alors séparation des récepteurs qui restent accrochés à la membrane vésiculaire et qui se regroupent pour former une vésicule secondaire, qui va au plus vite rejoindre la surface cellulaire dont elles sont issues et recycler ainsi le matériel membranaire.
Ce qui reste de l’endosome va subir une acidification toujours plus accentuée, ce qui va permettre une maturation et un tri de tous les substrats internalisés. L’endosome se met à gonfler, et à prendre l’aspect d’un réseau tubulaire qui contient de multiples vésicules (MVE : multi vésicules endosome) qui sont autant de micro éprouvettes de maturation pour les molécules qui y sont prisonnières. Là encore, des protéines de tri vont venir chevaucher la membrane endosomiale pour choisir les « bonnes » molécules et les entrainer dans le bon chemin, c’est à dire le golgi qui récupère tout ce qui est utile.
Ce qui n’est pas trié et choisi est considéré comme inutile : l’endosome (appelle alors endosome tardif, late endosome : LE) va se mêler à des granules extrêmement caustiques pour former des lysosomes de digestion totale des déchets.

LA VOIE EXOCYTAIRE : LES EXOSOMES
D’abord une précision d’importance : le mot exosome, en biologie moléculaire, représente deux entités à la fois complémentaires et bien différentes :
- l’exosome est un complexe protéique, qu’on peut trouver aussi bien dans le noyau (nucléole) que dans le cytoplasme, constitué de six protéines majeures rassemblées en tunnel, dont le rôle est de rassembler et de dégrader tous les petits ARN inutiles ou dont la mission (ARN messagers, ARN ribosomiques) est terminée. Tout ARN possède une capacité de traduction auprès d’effecteurs cellulaires, et il faut absolument faire un ménage interne permanent pour évacuer les molécules qui n’ont pas d’attribution précise. Ces ARN sont alors démantelés pour un recyclage dans le cytosol de leurs éléments constitutif : l’organisme, là encore, ne laisse rien perdre …
- l’exosome est également le support d’évacuation sous forme de microvésicules qui permet à la cellule de recycler les constituants membranaires (voir plus haut), d’expédier des productions cellulaires à destination physiologique bien précise, ou bien d’envoyer aux cellules alentour un signal moléculaire en fonction de leur état, de leur environnement. Dans certains cas, ces exosomes- vésicules peuvent contenir des ARN, par exemple d’origine virale (voir plus loin), ce qui permettra d’agir puissament sur les cellules alentour.
Dans cet article, nous traiterons uniquement des exosomes-vésicules, qui sont issues elles mêmes de vésicules d’endosomes internalisés, débarrassés des récepteurs du fait d’un recyclage moléculaire très précoce.
Les exosomes se distinguent par leur taille (30 à 100 nm selon les cellules et leur travail métabolique), et par leur forme particulière et homogène, ronde et aplatie au centre, donc en forme de globule rouge.

Le contenu va varier selon l’activité ou la « santé » de la cellule. On y trouvera classiquement des protéines d’adhésion et de trafic (coté externe de la vésicule, accrochées au cytosquelette, coté interne à des molécules spécifiques), des productions spécifiques (hormones, enzymes, neurotransmetteurs, etc), des molécules impliquées dans la présentation d’antigène (CMH1 et CMH2), et chez les cellules malades une grande quantité de protéines de stress (HSP) dans le cas du cancer ou d’inflammation, également une densité importante d’ARN inopérants chez les cellules infectées par des virus.
L’étude de la composition membranaire des exosomes montre une forte proportion de lipides robustes (céramides, sphingosides), mais aussi de phospholipides et de cholestérol permettant cette plasticité étonnante des vésicules.
L’observation de ces exosomes a été réalisée essentiellement en éprouvettes de laboratoire, mais ces vésicules ont été retrouvées dans plusieurs liquides biologiques : le plasma (viroses, cancer, inflammations), le liquide cérébro-spinal (exosomes contenant le prion PrP chez les brebis), ou l’urine (exosomes renfermant des marqueurs du cancer de la vessie et de nombreux autres syndromes). En fait, on trouve ces exosomes … lorsqu’on les cherche, mais il s’agit ici d’un protocole non reconnu et encore dévolu à la recherche.
Fonction des exosomes
Dans ce domaine de la cytologie, on n’a que trente ans de recul, avec une réelle prise de conscience de l’importance de ces exosomes depuis seulement dsept ou huit ans. On est désormais fixé sur le fait que quasiment toutes les cellules sont capables d’en produire, et que ces « vésicules poubelles » primitivement observées sont en fait des outils puissants et spécifiques de communication entre les cellules et de propagation de messages à travers l’organisme.
1- voie alterne de sécrétion de protéines.
La voie classique de sécrétion des protéines se fait via le réseau transgolgien : les protéines concernées possèdent un peptide signal qui permet sa reconnaissance et son transit depuis la production (réticulum), puis son apprêtement et son stockage (golgi), et enfin son excrétion directe dans le milieu extracellulaire.
Mais certaines protéines ne possèdent pas ce peptide signal, elles sont à la dérive dans le cytosol, mais alors intégrées dans les vésicules (MVE) d’endosomes et finalement mises en maturation et exportées via des exosomes. C’est le cas par exemple de l’IL1 (interleukine 1), une substance fondamentale d’alerte et de mise en route des fonctions inflammatoires et immunitaires.
2 – communication intercellulaire.
Certaines cellules communiquent plus que d’autres, ce sont les cellules de l’immunité.
Leur rôle régulateur du bon fonctionnement de l’organisme leur demande d’être à tout moment informées sur le type de cellules qu’elles côtoient, et sur leur état d’activité.
Pour cela, deux principes de fonctionnement étaient reconnus:
- l’envoi et la réception de molécules signal, les cytokines qui sont solubles dans le plasma sanguin,
- le contact direct entre cellules avec échange d’informations via des récepteurs membranaires et des protéines de présentation.
- mais désormais, il faut rajouter les exosomes qui jouent un rôle essentiel qu’on découvre à peine.
Pour bien comprendre certaines subtilités du système immunitaire, il faut s’arrêter sur un élément fondamental du langage des cellules : les molécules de présentation d’antigènes. Il s’agit de molécules protéiques qui se sont transformées au cours de l’Evolution, et avec les capacités immunitaires des nouvelles espèces.
Les protéines de stress
Dès les tout premiers êtres vivants, animaux comme végétaux, les protéines sont des molécules fragiles, qu’il faut protéger contre la chaleur ou la dessiccation. C’est le rôle de « protéines chaperon » qui sont produites en cas de stress cellulaires, on les appelle aussi « protéines de stress » ou « hot shot proteines » (HSP). Elles forment autour des molécules à protéger des sortes de civières qui en maintiennent la forme, donc les fonctions, pendant toute la durée du stress. Puis l’alerte terminée, elles s’ouvrent, libèrent leur contenu et sont recyclées dans les lysosomes. Rien ne se perd …
Chez tous les individus actuels, cette méthode de protection de la cellule est toujours valide, et nous avons dans nos gènes de quoi fabriquer les mêmes HSP que nos lointains lointains ancêtres de type algues rouges ou paramécies. Un système qui marche, on le garde !
Et ce ne sont pas les stress cellulaires qui nous manquent. Le chaud et le froid, bien sûr, mais aussi les inflammations dues aux infections, aux blessures. Et aussi à un stress particulier, l’hypoxie des cellules cancéreuses. Avec à la clef des stress supplémentaires apportés par les puissants traitements anti-tumoraux (chimios et radiothérapies). Dans ces cas de stress permanent, les HSP sont produites en continu, elles ne peuvent pas être entièrement recyclées et on les retrouvera en quantités à la surface membranaire de la cellule malade, le plus souvent avec encore dans leur « civière » les protéines qu’elles tentent de protéger, et qui sont caractéristiques de la maladie.
Mais fait nouvellement constaté, la cellule cancéreuse libère de très nombreux exosomes contenant des HSP, avec des conséquences fondamentales que nous détaillerons plus loin.
Les molécules CMH de classe 1
Elles sont apparues très tôt lors de l’évolution des animaux (et non pas des végétaux), en fait dès le stade pluricellulaire.
Il s’agit de molécules protéiques qui sont produites par toutes les cellules, et qui reconnaissent dès leur synthèse dans le réticulum, les molécules qui ne « collent pas » avec un bon état de santé. Par exemple des protéines virales, produites par la cellule par l’introduction d’ARN codant, par exemple des peptides anormaux produits lors de la multiplication anarchique des cellules cancéreuses.
Ces molécules CMH de classe 1 s’assemblent autour de ces anormalités et effectuent un trajet centrifuge vers la membrane cellulaire : elles « présentent » alors ces peptides incongrus sous forme d’un double message :
- voici la signature (il s’agit du peptide) d’une maladie cellulaire que l’organisme ne doit pas accepter. A garder en mémoire pour plus tard.
- La cellule qui porte cette doublette « CMH1 + peptide » représente un danger pour l’organisme, il faut l’éliminer.
Ce double message est à l’attention des cellules immunitaires en général, plus particulièrement aux lymphocytes mémoire et aux « cellules tueuses » qui vont tenter de détruire cette cellule malade.

Les molécules CMH de classe 2
Elles ne sont apparues que lors de la mise en place d’un « vrai » système immunitaire avec des cellules spécialisées dans la reconnaissance des intrus.
Il s’agit de molécules protéiques produites par l’organisme (là encore, dans le réticulum), mais qui se concentrent dans des vésicules particulières, les phagosomes. C’est là que finissent pour digestion tout ce que la cellule est capable de phagocyter, en particulier les micro-organismes (champignons, bactéries, micro-parasites). Et c’est là que ces molécules CMH2 s’assemblent autour de peptides qui sont la signature de la maladie, et qu’elles vont là encore migrer vers la surface cellulaire pour présenter ces peptides aux cellules voisines avec un message de type : « je suis en difficulté, merci de m’aider ». Au résultat, une production de substances (interleukines) par les voisines pour renforcer la cellule malade, mais aussi production d’anticorps spécifiques pour engluer les autres bactéries qui traînent dans le secteur …
Comme nous l’avons vu plus haut, les exosomes sont des petites vésicules qui intègrent une partie du contenu cellulaire, et une portion de la membrane plasmique : les trois types de molécules de présentation (HSP, CMH1 et CMH2) seront présentes à la surface des exosomes en fonction du métabolisme ou de la pathologie de chaque cellule. Et les exosomes servent donc à démultiplier les contacts (pour une cellule, des milliers d’exosomes) d’une part par leur nombre, mais aussi par leur fluidité et leur capacité à se déplacer sur de grandes distances , aller par exemple jusqu’à des ganglions pour rejoindre le effecteurs immunitaires.
Nous ne sommes qu’au début d’une bonne compréhension de ce phénomène, et de son champ d’applications en médecine. Mais il est deux domaines où les pistes d’actions thérapeutiques sont particulièrement prometteuses, qui sont le cancer et les infections virales.
Exosomes et immunité anti-tumorale.
Les rapports entre une tumeur cancéreuse et le système immunitaire sont très complexes. Il existe plusieurs « filières » d’activité, tant dans le sens d’une protection de la tumeur, que dans le sens de son éradication. Comme toujours, l’organisme vise à l’équilibre, et développe des freins à tout débordement. Dans le cas du cancer, 99,99% des tumeurs en devenir sont éradiquées dès qu’elles se manifestent, les autres mettent en route un cancer.
Puisque on peut compter sur les cellules immunitaires (sans pour autant comprendre pourquoi), autant les utiliser, et on va les « dresser » en les mettant en contact avec des cellules cancéreuses, avec en prime un nuage cytokinique adapté. C’est la grande époque des essais thérapeutiques basés sur l’action des lymphocytes T8 accompagnés d’une pincée d’Il2. Des résultats encourageants en éprouvettes, un échec cuisant sur des malades, avec même des incidents graves de type auto-immun …
Visiblement, il se produit lors de cancer un phénomène protecteur des cellules tumorales qui empêchent l’action des cellules immunitaires pourtant « gonflées à bloc » par les cytokines idoines.
Et là, il faut poser les éprouvettes, et réfléchir : la Nature étant une grande économe, on doit retrouver ce phénomène dans d’autres circonstances physiologiques ou pathologiques.
Effectivement, on assiste à un « switch » (en français, un retournement) d’un équilibre physiologique Th1/Th2 de la femme vers un état Th2, lors d’un événement particulier : la gestation.
En effet, le fœtus contient 50% de gènes d’origine paternelle, donc 50% de ses protéines (y compris les fameuses
protéines de reconnaissance CMH, voir plus haut), il constitue un élément immunologiquement étranger à l’organisme maternel.
En situation normale, le fœtus et son placenta seraient agressés par les lymphocytes maternels, avec à la clé un avortement systématique. C’est d’ailleurs la base d’une pathologie en gynécologie.
Mais dès le début de la gestation, un phénomène appellé pudiquement « tolérance » met en veilleuse tous les acteurs de l’action Th1 ainsi que les lymphocytes « killer » de l’immunité naturelle.
Ainsi survit le fœtus, ainsi également se réveillent des parasites jusque là paralysés par une action immunitaire spécifique. C’est le cas des toxoplasmes, reclus sous forme végétative dans des cellules de la mère, qui se réveillent d’un coup lors de la grossesse et infestent le fœtus par voie sanguine.
Ainsi également sont soulagées des femmes touchées par la sclérose en plaque, maladie auto-immunitaire de statut Th1, lorsqu’elles sont enceintes et que le « Switch » les apaise pour quelques mois …
Mais sur quel processus repose ce phénomène protecteur ?
Sur un plan local, on a bien remarqué que les placentas, tout comme les tumeurs solides, sont entourés d’un magma de cellules indifférenciées aux noyaux multiples, un syncicium.
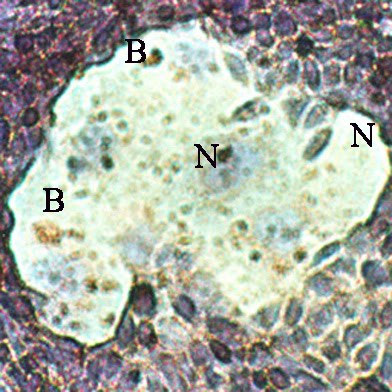
Ce tissu déstructuré et invasif peut s’introduire profondément dans les tissus voisins (chorion maternel ou tissu conjonctif), en particulier grâce à des enzymes spécifiques, les métalloprotéases. Ce syncitium présente des zones entières sans membrane, donc sans molécules de reconnaissance du CMH, donc sans possibilité de reconnaissance par les cellules immunitaires.
Mais ceci n’expliquait pas tout, en particulier les actions à distance, et les capacités de dissémination et de reprise des tumeurs dans des tissus lointains. Il fallait forcément un acteur qu’on n’avait jusque là pas remarqué. Donc qui était de petite taille … On a cherché des virus, on a trouvé les exosomes …
On a en effet isolé des microvésicules spécifiques dans les liquides biologiques chez tous les individus atteints de tumeurs cancéreuses ou de leucémie. Avec en surface des protéines spécifiques, ce qui en fait des marqueurs de la maladie jusqu’ici non exploités.
Mais aussi des molécules qui participent à l’apoptose des cellules, les Fas. Ces molécules s’échappent des tissus tumoraux qui leur sont insensibles, pour aller au devant des cellules de l’immunité qu’elles mettent à mal : anergie dans certains cas, apoptose (autodestruction) dans d’autres configurations.
Et il est de fait que l’adjonction de sérum de cancéreux (donc très riche en exosomes) à des cultures de lymphocytes entraine leur inaction contre des tumeurs jusque là sensibles, ou carrément leur disparition en quelques jours sous forme de globules d’apoptose.
Un autre rôle des exosomes tumoraux a été mis en avant par une équipe française (Clotilde Théry, Institut Curie) : ils influencent les cellules endothéliales des vaisseaux voisins pour édifier une nouvelle irrigation sanguine de la tumeur (angiogénèse), une fonction essentielle pour entrainer la croissance tumorale.
Encore une action des exosomes,
En cherchant mieux, on a trouvé des exosomes équivalents chez les femelles en gestation, également chez des transplantés d’organes où l’implant expédie des microvésicules immunosuppressives pour se maintenir en place.
Cette découverte rend problématiques les protocoles classiques de l’oncologie actuelle, qui consistent à matraquer les cellules tumorales : en fait, et sans même parler des effets secondaires sur les tissus sains, on comprend que plus on fait souffrir les cellules cancéreuses, plus elles produisent des exosomes dont les effets s’avèrent justement délétères.
Filtrer le sang pour le débarrasser des exosomes
Ces vésicules sanguines de très petite taille, peuvent être filtrées au cours de protocoles de type hémodialyse, mais au lieu d’utiliser des membranes dont le seul critère de passage est la taille des molécules sanguines, on utilise des cartouches qui obligent le flux sanguin à frôler et côtoyer des surfaces de résines glycosylées qui « accrochent » les exosomes.
Ce type de filtration très sélective a été introduit avec des traitements du Sida : on arrive ainsi à capter une grande quantité de particules virales qui ont également un effet immunodépresseur. Selon le même procédé, on peut débarrasser le sang de sa masse d’exosomes d’un facteur mille !
On peut jouer sur les molécules incluses dans les filtres de résines pour capter spécifiquement tel ou tel type d’exosomes. N’allons pas trop vite : si le principe est acquis, il n’est pas encore validé.
Pour autant, cette purification présente un autre avantage théorique : il permet de disposer de matériel antigénique (le contenu des exosomes) qu’on peut exploiter en laboratoire pour sensibiliser des lymphocytes tueurs aux protéines tumorales, puis à les réinjecter au malade, lui-même alors débarrassé des exosomes, donc en état de se défendre …
Les transferts et les actions des ARN
Les cellules en activité présentent une production permanente d’ARN de tous ordres, ARN messagers, ARN ribosomiaux, ARN de transfert, microARN de régulation, dont le rôle métabolique est très limité dans le temps.
Il existe un système rémanent de récupération de toutes ces molécules non seulement inutiles, mais qui risquent d’interférer gravement avec l’activité cellulaire.
Ces ARN sont donc reconnus, collectés, et rassemblés dans des vésicules. La plupart seront digérés sur place pour en recycler les éléments constitutifs.
Mais lorsque la machine s’emballe (cellules grosses productrices de protéines, cellules infectées par des virus), la charge en ARN dépasse largement la capacité cellulaire de recyclage, et la stratégie de la cellule va s’inverser : il s’agit alors de se débarrasser de ces ARN, et d’alerter les cellules voisines du désastre, afin qu’elles interviennent pour soulager l’organisme.
Les exosomes remplis d’ARN auront dès lors deux rôles:
- un rôle de transfert d’ARN, qui permet à des cellules voisines de prendre le relais pour produire les mêmes substances que la cellule émettrice d’exosomes. Ainsi, si l’on place des exosomes de mastocytes de souris dans une culture de mastocytes humains, on voit ces cellules humaines exprimer des protéines de souris codées par les ARN importés via les exosomes. De même, des exosomes de cellules cancéreuses (glioblastomes) mis en contact avec des cellules endothéliales saines, entrainent la production de EGFR (endothélial growth factor receptor), et provoquent une prolifération dangereuse de ces cellules. Ce qui nous fait dire que la prétendue sécurité des OGM qui ne pourraient pas disséminer les gènes introduits est une vaste fumisterie qui ne peut convaincre que des incompétents.
- Un rôle de « pro-cytokine » qui peut avoir un impact énorme sur le plan immunitaire. Revenons au processus d’invasion virale d’une cellule :
Les particules virales comportent généralement le génome viral (ADN, ou, dans notre cas le plus général, de l’ARN), ainsi que des protéines structurales de reconnaissance et de mobilité.
Lorsque la cellule met au service du virus toute sa machinerie enzymatique, ainsi que sa réserve d’acides aminés et de nucléotides, elle produit en très grande quantité des particules virales complètes (ARN + protéines structurales), le tout à recouvrir d’une couche membranaire « empruntée » lors de l’évasion cellulaire.
Mais elle produit également, et dans des proportions considérables, des particules virales incomplètes qui diffèrent des précédentes par leur composition de protéines d’accompagnement, ou par la qualité du génome viral encapsulé. Ces génomes tronqués, générés à la suite d’erreurs de transcription de la polymérase virale, ou par digestion nucléidique partielle, sont encapsidés dans des vésicules apparentées aux exosomes et expédiés dans l’espace extra-cellulaire dans des proportions de 1000 exosomes pour un virus valide !
Une perte nette de mille pour un, dans un contexte d’économie (pour ne pas dire de radinisme) cellulaire, ce n’est pas concevable … Ces exosomes ont forcément une fonction qui nous échappe…
En tous cas, qui n’a pas échappé à Sonia Assil, Elodie Décembre et Marlène Dreux (Inserm U758), qui ont étudié le cheminement des exosomes à ARN vers les cellules dendritiques, avec leurs conséquences immunitaires.
Les cellules dendritiques sont des cellules immunitaires produites par la moelle osseuse sons forme de monocytes circulants, qui vont s’installer dans toutes les interfaces où l’organisme doit contrôler ce qui circule ou tente de pénétrer : antigènes aériens ou alimentaires, bactéries, cellules mobiles et anticorps de toutes provenances …
Au fil de leurs rencontres, ces cellules dendritiques sont capables de produire des quantités importantes de cytokines antivirales, en particulier les interférons de type1, interférons alpha et béta, médiateurs de la réponse immunitaire innée. Cette réponse aux interférons passe par le blocage de la propagation virale en paralysant ses composants de structure, ou bien par la destruction des cellules infectées par les lymphocytes tueurs (« killers ») qui les reconnaissent via leurs protéines de choc en surface.
Hé bien justement, les ARN apportés par les exosomes sont de puissants inducteurs d’interférons, et leur rôle est alors tout trouvé : ils sont là pour contrer le déséquilibre dû à l’infection virale, ils mettent en route une immunité qui va ralentir l’infection et débarrasser l’organisme des cellules malades.
Ceci est particulièrement d’actualité avec l’injection à des milliards d’individus de vaccins à ARN, qui justement vont introduire des masses d’ARN messagers dans divers tissus: quelle sera leur devenir, et dans les cellules, et dans leur environnement à travers l’action des exosomes …
Les chercheuses citées plus haut ont, lors d’une infection, bloqué la production d’endosomes (utilisation d’inhibiteurs tels que le GW4869 ou le spiroepoxide) : la production d’interférons s’arrête net, alors que les virus complets continuent d’être produits par les cellules malades. C’est la preuve que les virus complets et les ARN « ratés » ont des voies de sortie cellulaire différentes, et que les ARN nus s’échappent uniquement via des exosomes.
On a donc une action opposée des virus qui cherchent à étendre l’infection à d’autres cellules, et les exosomes qui au contraire, excitent les cellules immunitaires afin de contrer cette prolifération.
Jusqu’à présent, on pensait que la production d’interférons par les cellules dendritiques était induite par l’internalisation des virus (par exemple, le virus de la grippe). Hé bien non, le virus joue sa carte propre, mais il est est contrecarré par ses propres déchets métaboliques, voilà qui est nouveau et bigrement intéressant.
Intéressant et très prometteur, car l’interféron a une action puissante, c’est très bien, mais surtout une action non spécifique : si un virus se développe et produit des exosomes, les interférons élaborés auront une action globale sur toute cellule infectée ou toute cellule cancéreuse.
Un exemple, déjà ancien : on a bien observé que les organismes dans lesquels on laisse se développer des parvovirus, se défendent étonnamment bien contre des tumeurs. Pourquoi ? on ne savait pas. La réponse la plus probable : les exosones.
Un autre exemple, celui d’une technique thérapeutique autrefois très prisée car efficace, mais mise au rencart parce que obscure dans sa compréhension. Cette technique consiste à prélever du sang veineux (10 ml chez les humains) et à le réinjecter dans des zones riches en cellules immunitaires (en sous cutané ou mieux, en intra dermique). Nous l’avions bien explicité dans les numéros (introuvables maintenant) 2 et 4 d’Effervesciences. A la lumière des travaux évoqués ci-dessus, les exosomes du sang réinjectés en zones immunologiquement favorables sont à eux seuls en mesure de contrer ’infection primordiale. Et c’est parfaitement valable pour toute virose. Avec en prime une action d’immunothérapie naturelle susceptible de débarrasser l’organisme des petites tumeurs naissantes, selon l les préconisations du Dr Gernez .
Cette nouvelle compréhension de l’immunité est trop récente pour avoir des retombées cliniques immédiates. Mais elle nous montre des pistes de thérapies « à la carte » pour chaque malade, avec pour bases moléculaires des éléments cellulaires issus des malades eux-mêmes, et pour finalité de restructurer l’organisme et le mettre en état de se défendre, plutôt que de lui infliger des remèdes toxiques et forcément délétères …
Jean-Yves Gauchet
A lire également: “ce qui me chipote avec les vaccins à ARN”
